Koronavirusi: çast pas çasti
Amerikanët mund të vaksinohen para fundit të vitit
Nëse FDA miraton vaksinën, kompania është e përgatitur të shpërndajë “qindra mijëra doza”
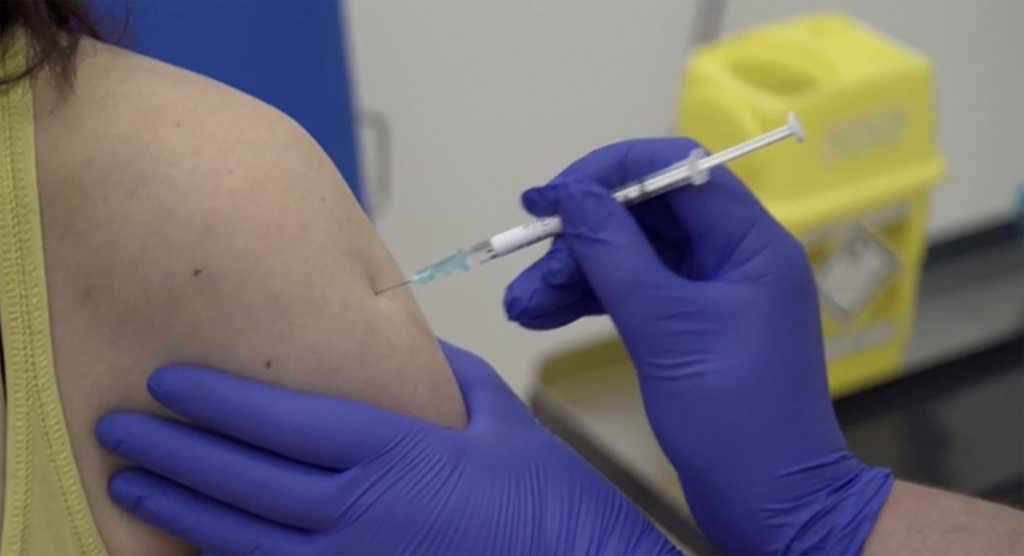
Vaksina e koronavirusit të Pfizer mund t’u shpërndahet amerikanëve para fundit të vitit nëse zbulohet se është e sigurt dhe efektive, tha CEO i kompanisë, Albert Bourla.
Prodhuesi i ilaçeve duhet të ketë të dhëna kryesore nga prova e tij në fazën e vonë për Administratën e Ushqimit dhe Barnave deri në fund të Tetorit, tha Bourla gjatë një interviste në CBS “Face the Nation”. Nëse FDA miraton vaksinën, kompania është e përgatitur të shpërndajë “qindra mijëra doza”, tha ai.
Për shkak të pandemisë, zyrtarët shëndetësorë amerikanë dhe prodhuesit e ilaçeve kanë përshpejtuar zhvillimin e kandidatëve për vaksina duke investuar në faza të shumta të hulumtimit edhe pse duke e bërë këtë mund të jetë asgjë nëse vaksina përfundon të mos jetë efektive ose e sigurt, transmeton Scan.
Gjiganti farmaceutik amerikan ka punuar së bashku me prodhuesin gjerman të ilaçeve BioNTech. Në korrik, qeveria amerikane njoftoi se do t’u paguante kompanive 1.95 miliardë dollarë për të prodhuar dhe shpërndarë 100 milion doza të vaksinës së tyre nëse provohet e sigurt dhe efektive. Marrëveshja u nënshkrua si pjesë e Operacionit Warp Speed, përpjekja e administratës Trump për të përshpejtuar zhvillimin dhe prodhimin e vaksinave dhe trajtimeve për të luftuar koronavirusin, përcjell albinfo.ch.
Bourla tha se kompania ka investuar tashmë 1.5 miliard dollarë për zhvillimin e vaksinës së mundshme. Ai tha se nëse vaksina nuk funksionon do të ishte financiarisht “e dhimbshme” për kompaninë.
“Në fund të ditës, janë vetëm para. Por kjo nuk do ta prishë kompaninë, megjithëse do të jetë e dhimbshme”, tha ai.
Vaksina eksperimentale e Pfizer përmban material gjenetik të quajtur ARN-të dërguar, ose ARN, për të cilën shkencëtarët shpresojnë se provokon sistemin imunitar për të luftuar virusin.
Pfizer është një nga tre kompanitë që janë aktualisht në fazat e vona të testimit për një vaksinë. Dy të tjerët janë Moderna dhe AstraZeneca, të cilët njoftuan se do të rifillonin punën pas një pauze të përkohshme për arsye sigurie.
Pfizer paraqiti një propozim në FDA për të zgjeruar provën në fazën e vonë për të përfshirë deri në 44,000 pjesëmarrës, një rritje e konsiderueshme nga objektivi i saj i mëparshëm prej 30,000.
Zhvillimet vijnë ndërsa ekspertët dhe shkencëtarët e sëmundjeve infektive javët e fundit kanë thënë se kanë shqetësime se Presidenti Donald Trump po bën presion tek FDA për të miratuar një vaksinë para se të testohet në mënyrë adekuate.
Komisioneri i FDA Stephen Hahn, duke këmbëngulur se ai nuk ishte nën presion nga Trump për të ndjekur me shpejtësi një vaksinë, i tha Financial Times muajin e kaluar se agjencia është e përgatitur të anashkalojë procesin e plotë të miratimit federal në mënyrë që të bëjë të mundur vaksinën Covid-19 sa më shpejt sa të jetë e mundur.
Më 8 shtator, nëntë ndërmarrje të barnave, përfshirë Pfizer, lëshuan një letër duke u zotuar se do t’i jepnin përparësi sigurisë dhe do të mbanin “integritetin e procesit shkencor” në përpjekjet e tyre për të zhvilluar vaksinat e koronavirusit.
E-Diaspora
-
 BQK: Mbi 112 milionë euro i sollën mërgimtarët në Kosovë vetëm gjatë marsit Pa dyshim se një nga shtyllat kryesore të ekonomisë së Kosovës janë remitencat nga e mbarë...
BQK: Mbi 112 milionë euro i sollën mërgimtarët në Kosovë vetëm gjatë marsit Pa dyshim se një nga shtyllat kryesore të ekonomisë së Kosovës janë remitencat nga e mbarë... -
 Mitrovicasi Semir Aliti nënshkroi kontratë me ekipin holandez, PSV
Mitrovicasi Semir Aliti nënshkroi kontratë me ekipin holandez, PSV -
 Pas pushimit pranveror, rinis mësimi plotësues i gjuhës shqipe në shkollën Ostermundigen Bern
Pas pushimit pranveror, rinis mësimi plotësues i gjuhës shqipe në shkollën Ostermundigen Bern -
 Promovohet në Zvicër romani i Mimoza Hysës “Bijat e gjeneralit”, në përkthimin gjerman
Promovohet në Zvicër romani i Mimoza Hysës “Bijat e gjeneralit”, në përkthimin gjerman -
 “Më 31 dhjetor ju mbaron leja e qëndrimit”: Një letër që po frikëson të huajt në Zvicër
“Më 31 dhjetor ju mbaron leja e qëndrimit”: Një letër që po frikëson të huajt në Zvicër
Jeta në Zvicër
-
 Zvicër: Më 2024 priten më shumë zjarre për shkak të ngrohjes globale Parashikimet e Institutit për Studimin e Borës dhe Orteqeve (SLF) tregojnë gjithashtu se periudha me probabilitetin...
Zvicër: Më 2024 priten më shumë zjarre për shkak të ngrohjes globale Parashikimet e Institutit për Studimin e Borës dhe Orteqeve (SLF) tregojnë gjithashtu se periudha me probabilitetin... -
 Zviceranët duan të ulin kostot e kujdesit shëndetësor
Zviceranët duan të ulin kostot e kujdesit shëndetësor -
 Ish-presidenti thotë se Zvicra duhet të anëtarësohet në BE
Ish-presidenti thotë se Zvicra duhet të anëtarësohet në BE -
 Si të shpejtoni aplikimin tuaj për shtetësinë zvicerane
Si të shpejtoni aplikimin tuaj për shtetësinë zvicerane -
 Amnesty International kritikon Zvicrën
Amnesty International kritikon Zvicrën

























